Les analyses de laboratoire
Mieux les connaître pour une meilleure utilisation
Le recours au laboratoire => Les analyses de laboratoire en médecine vétérinaire sont nombreuses d’où la nécessité de mieux les connaître pour mieux les utiliser.
Autopsie, parasitologie, bactériologie, virologie, PCR, sérologie, ELISA… Le vocabulaire de laboratoire est riche et il est parfois difficile de s’y retrouver. Connaître quelques définitions permet de mieux comprendre les analyses et ce que l’on peut en attendre.
Une analyse directe ou indirecte
Une technique d’analyse directe permet de détecter le pathogène lui-même, un élément comme son ADN ou une protéine de surface, ou les œufs qu’il produit pour les parasites. C’est la technique de référence mais elle n’est pas toujours possible compte-tenu de la localisation du microbe (poumon, foie…). Une technique d’analyse indirecte permet de détecter non pas le pathogène lui-même, mais une trace – souvent immunitaire – de sa présence : trace cellulaire (tuberculination) ou humorale via les anticorps correspondants. Ces derniers sont des molécules spécifiques, produites par le système immunitaire de l’animal et destinées à lutter contre un pathogène en particulier. Détecter un anticorps, c’est « indirectement » détecter l’agent pathogène auquel il correspond.
Techniques directes : autopsie, coprologie, bactériologie, virologie
L’autopsie (examen du cadavre et de ses lésions) est une étape importante pour orienter un diagnostic. Elle apporte d’autant plus d’informations qu’elle est effectuée précocement (idéalement dans les 24 h qui suivent la mort de l’animal).
La coprologie dépiste des parasites par la mise en évidence des œufs ou des larves dans les fèces. Cette technique est imparfaite, certains parasites pondent peu ou de manière irrégulière, d’autres voient leur ponte limitée par l’immunité de l’hôte.
A partir d’échantillon d’organe, de sang, d’urine, de fèces… la bactériologie identifie les bactéries qui s’y trouvent. Le choix du milieu de culture varie en fonction du type de bactérie recherchée et donc de la suspicion initiale du vétérinaire.
La virologie, technique plus complexe, nécessite des moyens importants. Elle est réservée à la recherche. Au quotidien, la mise en évidence des virus se fait par PCR ou de manière indirecte (sérologie).
L’antibiogramme, pour un bon usage des antibiotiques
Un antibiogramme teste in vitro la capacité d’un panel d’antibiotiques à empêcher de se développer une bactérie isolée sur un prélèvement. Il permet une approche de l’efficacité des principales familles d’antibiotiques contre la bactérie isolée. L’antibiogramme demande à être utilisé de manière raisonnée pour les raisons suivantes :
- Un nombre limité d’antibiotiques (une quinzaine) est testé, une interprétation par le laboratoire permet d’élargir le résultat à un groupe de molécules et de définir les différents phénotypes de sensibilité et de résistance.
- Même si l’antibiogramme est réalisé sur une bactérie à pouvoir pathogène, la bactérie isolée n’est pas toujours celle qui est responsable de la maladie.
- L’efficacité in vitrone correspond pas toujours à ce qui peut se passer dans les conditions réelles. Pour être efficace in vivo, l’antibiotique doit arriver sur le site de l’infection et avoir un temps de contact suffisant pour agir.
Une connaissance des antibiotiques et de leurs propriétés in vivo est aussi précieuse que le résultat d’un antibiogramme ; un antibiogramme complet comprend à la fois la liste des molécules auxquelles la bactérie est sensible ou résistante, et son interprétation.

Le cercle d’inhibition permet de mesurer la sensibilité des bactéries aux antibiotiques. Ici, on voit que la bactérie est sensible à la colistine et à l’apramycine (première ligne coin droit et coin gauche) et multi-résistante aux autres antibiotiques (tétracyclines, sulfamides…).
La PCR, technique directe détectrice de matériel génétique
Les bactéries et les virus, comme tout organisme vivant, contiennent des molécules d’ADN ou d’ARN, supports de leur code génétique. La PCR, méthode de biologie moléculaire d’amplification génique in vitro, permet de dupliquer en grand nombre (avec un facteur de multiplication de l’ordre du milliard) une séquence d’ADN ou d’ARN connue, à partir d’une faible quantité d’acide nucléique. Ainsi, peut-être identifiée la présence de bactérie ou de virus, ou mesurée une charge virale ou bactérienne. La PCR est une technique directe qui révèle de très faibles quantités de bactéries ou de virus.
La sérologie, une technique indirecte
La sérologie informe sur la présence ou non dans l’organisme d’anticorps, témoins d’une contamination. Selon les agents, ces anticorps apparaissent entre quelques jours (viroses respiratoires), 15 jours (virus IBR) et quelques années (paratuberculose). En début d’évolution, un animal peut être malade et présenter une sérologie négative. Les anticorps persistent de quelques semaines à plusieurs années selon les maladies. Une sérologie positive n’implique donc pas forcément l’agent détecté dans l’épisode clinique observé. La persistance des anticorps indique souvent le passage du germe alors qu’il a été éliminé, ou s’il persiste, dans des conditions qui ne permettent plus de le mettre en évidence (comme le virus IBR chez les bovins, qui peut se « cacher » plusieurs années dans certains ganglions, mais qui est « trahi » par la présence des anticorps).
Pour les parasites, la sérologie n’est utilisable que s’il y a production d’anticorps, ce qui reste rare. La grande douve ou la besnoitiose sont dépistables sur prise de sang.
Les techniques sérologiques disponibles sont nombreuses, différentes avec des niveaux de performances différents. Chacune peut être spécifique d’un type d’anticorps et donc d’un seul microbe ou groupe de microbes. Seule une bonne connaissance des techniques d’analyse, des caractéristiques des germes et de la nature et la persistance des anticorps produits permet d’utiliser et d’interpréter correctement la sérologie.
On parle de technique ELISA, de quoi s’agit-il ?
Cette abréviation regroupe une famille de techniques basées sur la mise en contact entre un anticorps et un microbe (ou un fragment de microbe), puis la fixation sur ce « complexe » d’un colorant spécifique. Les techniques ELISA s’appuient sur la lecture finale d’une intensité de coloration ou « densité optique » (DO). Des outils de mesure quantifient ces DO et cela peut aboutir, dans certains cas, à un dosage des anticorps ou des microbes présents. Les techniques ELISA sont le plus souvent indirectes (recherche d’un anticorps) mais peuvent aussi détecter des protéines virales (ELISA BVD antigène).
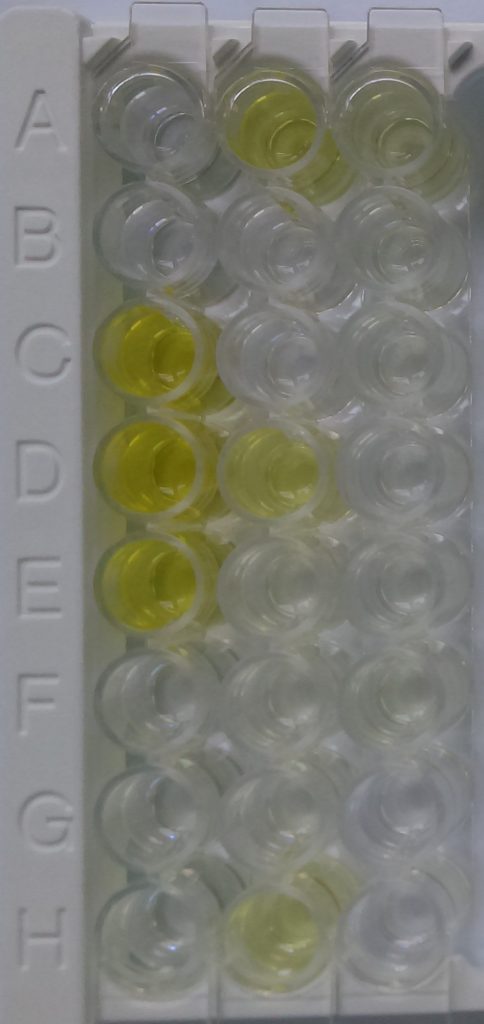
La technique Elisa permet le diagnostic des maladies par l’observation de variations de « couleur » (en fait, densité optique : DO). Ici une plaque ELISA IBR avec en A1-B1 les témoins négatifs, en C1-D1 les témoins positifs, en E1 le sérum étalon puis les sérums individuels de terrain avec A2-D2-F2 sérums faiblement réactifs inférieurs au seuil de positivité.
Sensibilité et spécificité, des notions essentielles mais complexes
La sensibilité d’un test diagnostique est la capacité du test à détecter la maladie quand elle est présente : le risque encouru est de donner un résultat « faussement négatif » alors qu’en réalité le microbe recherché est présent. Par exemple, les analyses sérologiques pour détecter la paratuberculose peuvent, chez des bovins qui ne sont pas en phase clinique, le « rater » dans 50 à 75 % des cas et donner des résultats « faux-négatifs », ce manque de sensibilité est compensé par la répétition des analyses dans un troupeau.
La spécificité est la capacité du test à ne trouver que le microbe recherché ; le risque est d’indiquer positif alors que le microbe recherché est absent. On parle alors de « faux positif ». Ainsi, le test intradermique pour la tuberculose chez les bovins détecte la quasi-totalité des animaux tuberculeux, mais réagit aussi positivement pour des animaux qui ne portent pas la tuberculose mais certaines bactéries « cousines ». Ce manque de spécificité est compensé par des analyses complémentaires. Les producteurs de kits d’analyses essaient de mettre au point des outils à la fois sensible et spécifique, tout en sachant qu’aucune technique n’obtiendra jamais 100 % sur les deux points.
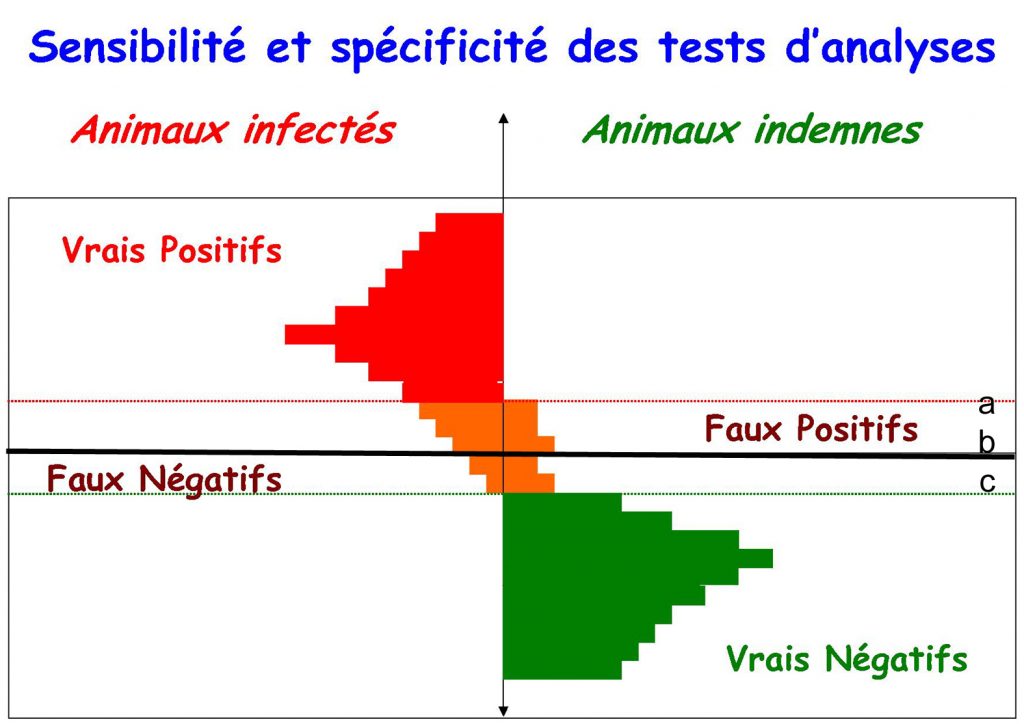
Sur le schéma, on remarque deux sous-populations importantes (rouges : infectés, vertes : indemnes). Il existe une zone intermédiaire (orange) correspondant aussi bien à des animaux indemnes qu’infectés avec une plus grande proportion d’animaux indemnes entre a et b et une plus grande proportion d’animaux infectés entre b et c. Si l’on choisit comme valeur seuil, celle relative à la ligne a, on supprime les faux négatifs mais on augmente considérablement les faux positifs. A l’inverse, si la valeur seuil choisie est la ligne c, on a plus de faux positifs mais le nombre de faux négatifs augmente fortement. Cela implique de faire un choix afin de trouver un équilibre raisonné entre la spécificité et la sensibilité d’un test donné. L’application d’un test de dépistage conduit inéluctablement à un risque de faux résultats dont le niveau dépend des qualités intrinsèques du kit.
Une utilisation à raisonner avec votre vétérinaire
Prescrire l’analyse adéquate est un exercice difficile et interpréter les résultats l’est tout autant ! Ces techniques se retrouvent dans les différents plans de notre boîte à outils GDS Creuse. Le recours raisonné au laboratoire appartient au métier de votre vétérinaire, comme le choix des médicaments. Echangez avec lui pour une utilisation efficiente et une limitation des coûts.





 envoi en cours...
envoi en cours...