Strongles gastro-intestinaux en élevage ovin
Analyser pour raisonner vos interventions
Plan antiparasitaire => Les strongles gastro-intestinaux sont une dominante pathologique en élevage ovin. L’apparition de résistances de ces parasites aux anthelmintiques nécessite de revoir la gestion du parasitisme dans les troupeaux. GDS Creuse vous accompagne.
 La gestion des strongles dans les troupeaux a longtemps été basée sur des traitements « en aveugle » de tous les animaux du troupeau et plusieurs fois dans la saison. Ce modèle montre ses limites : le contexte économique est fragile, le nombre de molécules disponibles se réduit et de nombreuses résistances apparaissent. Le traitement demande donc à être le fruit d’une réflexion et à prendre en compte plusieurs paramètres : statut des animaux, résultats de coprologies, gestion des pâtures, choix des molécules…
La gestion des strongles dans les troupeaux a longtemps été basée sur des traitements « en aveugle » de tous les animaux du troupeau et plusieurs fois dans la saison. Ce modèle montre ses limites : le contexte économique est fragile, le nombre de molécules disponibles se réduit et de nombreuses résistances apparaissent. Le traitement demande donc à être le fruit d’une réflexion et à prendre en compte plusieurs paramètres : statut des animaux, résultats de coprologies, gestion des pâtures, choix des molécules…
Un cycle des strongles à connaître
Le mouton peut être parasité par différentes espèces de strongles, les plus fréquentes étant Teladorsagia et Haemonchus dans la caillette et Trichostrongylus dans l’intestin grêle. Tous partagent un cycle comparable (cf. illustration) avec excrétion d’œufs dans les crottes qui éclosent et se transforment en L3 au pré, larves qui seront ingérées pour boucler le cycle. Les larves se développent selon la température, l’optimal se situant entre 25 et 30°C. Le cycle peut donc varier de 1 à 4 semaines en fonction du milieu. Avec une météo favorable, de l’humidité et une température clémente, plusieurs cycles consécutifs sont observés et la contamination des pâtures s’accroit inexorablement. Seuls des épisodes de sécheresse ou le froid hivernal cassent cette dynamique.
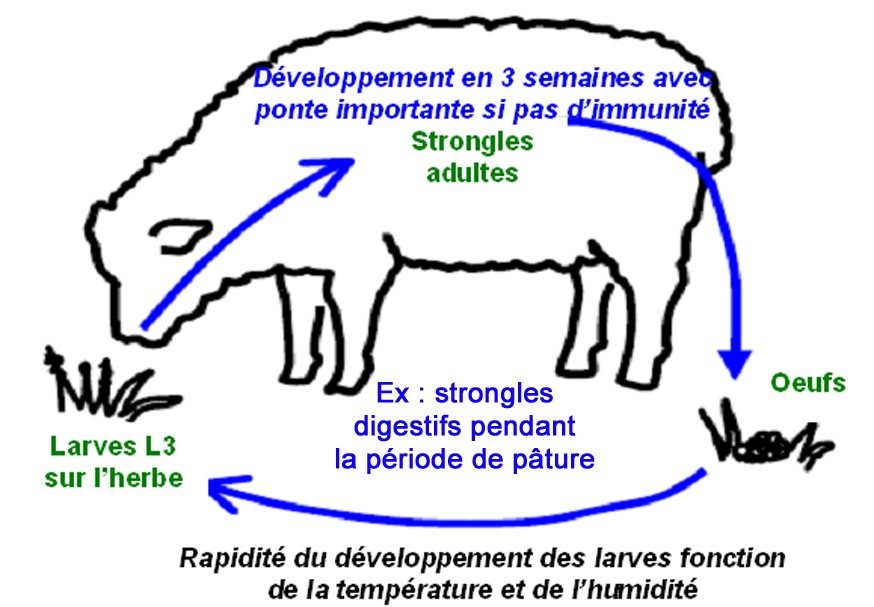
Les strongles chez les ovins présentent un cycle très simple et très efficace. Les deux principaux facteurs de variation sont l’immunité des moutons et les facteurs climatiques qui conditionnent la persistance des larves et leur vitesse de développement. Les larves se concentrent dans les cinq premiers centimètres de l’herbe, tout surpâturage favorise la contamination.
Un impact majeur sur les jeunes
Les agneaux n’ayant jamais été en contact avec les parasites sont les principaux animaux touchés. Ils vont présenter de l’amaigrissement, une baisse de l’ingestion et de la diarrhée. En cas de contamination par Haemonchus, la diarrhée est absente mais une anémie rapide et parfois fatale s’installe. Un agneau parasité peut perdre plus d’un litre de sang en quelques semaines ! Pour l’éleveur, les critères d’alerte sont un affaiblissement des agneaux, des muqueuses blanches, des œdèmes de l’auge voire des mortalités soudaines. Un traitement d’urgence s’impose alors.
L’immunité, un pilier de la gestion des strongles
Passé 18 mois, l’immunité s’installe et les ovins ingérant des larves vont les détruire ou les inhiber avant qu’elles ne deviennent excrétrices. Cette immunité varie en fonction des individus, de l’alimentation ou d’un stress. Ainsi, un relargage d’œufs de strongles par les brebis est observé autour de la mise-bas. Cette période est donc à risque pour la contamination, d’autant plus que les agneaux vont pâturer peu de temps après. On observe également des moutons génétiquement plus sensibles aux strongles, qualifiés de « super-excréteurs ». Leur identification et l’élimination de leur descendance est une piste à creuser dans la sélection des agnelles de renouvellement, y compris par la sélection des béliers. Les brebis issues d’un père résistant excrètent en moyenne deux à trois fois moins d’œufs dans les fèces que les filles d’un bélier sensible.
La coprologie de mélange, un outil simple et peu onéreux avec une aide de GDS Creuse
L’intensité d’excrétion d’œufs (OPG) est un reflet imparfait du nombre de vers présents chez l’animal prélevé mais un très bon indicateur de son effet « contaminateur » pour le pâturage. L’OPG reste pertinent tout au long de la vie chez les ovins et caprins contrairement aux bovins. L’Unité Mixte Technologique « Maîtrise de la Santé des petits ruminants » a validé une méthode de coprologie de mélange (cf. illustration). Elle permet d’évaluer à moindre prix l’intensité du parasitisme par les strongles gastro-intestinaux. , elle est prise en charge à 50 % par GDS Creuse pour ses adhérents. En fonction du résultat obtenu, l’éleveur et son vétérinaire évaluent si un traitement est nécessaire ou pas. Cette méthode d’évaluation de l’intensité du parasitisme peut diminuer les traitements, donc limiter la pression de sélection sur ces parasites et la diffusion de la résistance. Les indicateurs cliniques ou zootechniques sont des indicateurs complémentaires de la coproscopie de mélange.
Important!
Plan parasitisme
Un protocole d’accompagnement technique et financier vous est proposé en réalisant des analyses coproscopiques. La collecte de fèces doit être réalisée sur au minimum 5 individus d’un lot homogène (agnelles d’une part, brebis d’autre part) avec des prélèvements individuels (15-20 grammes suffisent) fournis au laboratoire qui réalise le mélange pour une coprologie de mélange. Vous pouvez utiliser un gant de fouille et faire un nœud entre chaque prélèvement. Pensez à joindre et agrafer vos commémoratifs, ils doivent comporter : N° EDE, Nom du client et du vétérinaire, N° ou nom du lot, date de prélèvement et la classe d’âge. Son coût est de 10 € HT pour les adhérents GDS Creuse. Réalisée selon les préconisations, elle est prise en charge, en plus du tarif négocié, à 50 % par GDS Creuse. La refacturation se fait aides déduites à l’éleveur dans le cadre du tiers payant intégral ruminants « suivi sanitaire ».
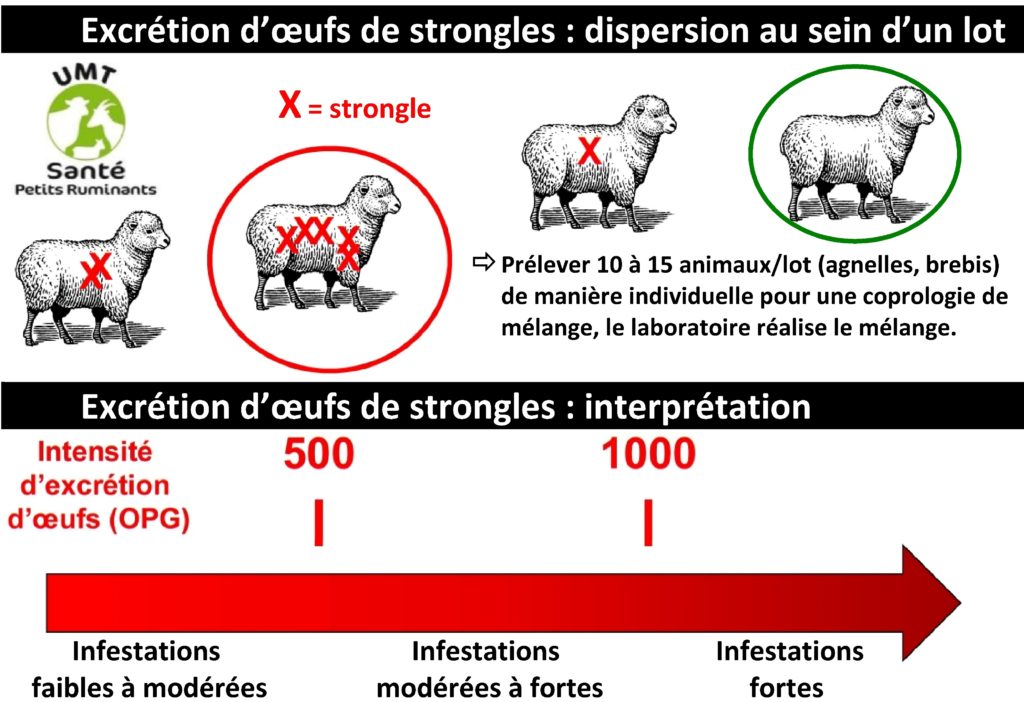
Du fait de la variabilité d’excrétion suivant les individus, la collecte de fèces doit être réalisée sur des individus d’un lot homogène (agnelles d’une part, brebis d’autre part) avec des prélèvements individuels fournis au laboratoire qui réalise le mélange pour une coprologie de mélange. L’interprétation des résultats (œufs par gramme de fèces (OPG)) est à pondérer selon l’âge des animaux, leur état, la conduite d’élevage…
Une gestion des pâtures à maîtriser
Empêcher les animaux d’excréter trop d’œufs dans les pâtures est le principal objectif. Pour cela, on évitera le surpâturage ou des chargements trop importants et on réalisera des traitements ciblés sur les animaux à risque, comme les brebis autour de l’agnelage ou les agneaux présentant une infestation. En revanche, on traitera le moins possible les animaux résistants, à savoir les adultes ne présentant pas de clinique. Cela permet de stimuler l’immunité de prémunition du troupeau et de limiter l’apparition de résistance par relargage dans l’environnement de strongles non-exposés aux anthelmintiques, appelée « population refuge ». Enfin, on limitera le temps de séjour sur les parcelles, afin de casser les cycles parasitaires. Une rotation de pâture tous les 5 à 7 jours et l’absence de retour sur une parcelle pâturée avant 6 semaines permet d’assainir les terrains.
Varier les familles de molécules de traitement
Si les marques de produits anthelmintiques sont nombreuses, il n’y a en fait que deux familles principales, les benzimidazoles et les lactones macrocycliques. Lorsqu’une résistance apparait pour une molécule, ce sont toutes les molécules de la famille qui sont devenues résistantes. Si ce phénomène reste marginal en élevage bovin, c’est une réalité déjà bien implantée en Creuse en élevage ovin. On constate de très nombreuses résistances aux benzimidazoles, et des résistances émergentes aux avermectines. Une coproscopie effectuée dans les jours qui suivent un traitement permet de mesurer l’apparition de ces résistances. Il faut impérativement varier les traitements anthelmintiques, en introduisant dans les protocoles des molécules d’autres familles, comme le monépantel, le lévamisole, le closantel ou le nitroxynil.
Des solutions alternatives à évaluer
Des solutions phyto-thérapeutiques sont proposées… mais encore très majoritairement non-évaluées ! Chaque nouvelle solution proposée demande une comparaison coprologique avant-après traitement. Des études démontrent un impact favorable de la consommation de plantes à tannins comme le sainfoin ou la chicorée. Le pâturage commun ou alterné avec d’autres espèces comme les chevaux ou les bovins permet une réduction de la contamination des parcelles par ingestion des larves qui seront détruites.
Traiter mieux, traiter moins
Il est important de bien gérer l’arsenal thérapeutique existant en appliquant des règles de bonnes pratiques de traitement selon la formule « traiter mieux, traiter moins ». A tout point de vue, le plan antiparasitaire demande une gestion rationnelle adaptée à son élevage. Cela passe par l’utilisation des outils disponibles et leur intégration raisonnée impliquant les éléments d’observations cliniques et de suivis des cycles de pâturage. Chaque éleveur peut appliquer ce schéma dans son élevage en collaboration avec le vétérinaire en charge du suivi de son élevage, GDS Creuse restant à la disposition de tout éleveur intéressé par des compléments d’information.
Important!
 Les bases de la gestion des strongles en élevage ovin :
Les bases de la gestion des strongles en élevage ovin :
- Avoir des animaux bien nourris et en bon état.
- Bien connaître les cycles des strongles et l’impact de la météo.
- Raisonner en fonction de l’immunité des animaux : âge, période de mise-bas.
- Favoriser la sélection d’animaux génétiquement résistants.
- Faire des coprologies et raisonner leur interprétation.
- Gérer le parcellaire : chargement, rotation de pâture, plantes à tannin.
- Mettre les agneaux sur les parcelles les plus saines.
- Choisir les molécules en fonction de l’historique et de l’âge des animaux à traiter.
- Isoler et traiter tous les animaux introduits.







 envoi en cours...
envoi en cours...